BENTUK MOLEKUL
BENTUK MOLEKUL
Dalam pembelajaran ini, siswa akan memiliki
kemampuan:
1.
Menganalisis teori jumlah pasangan elektron di sekitar inti atom (Teori Domain Elektron)
untuk menentukan bentuk molekul.
2. Meramalkan bentuk molekul berdasarkan teori jumlah pasangan elektron di sekitar inti atom (Teori Domain Elektron).
1.
Bentuk
Geometri Molekul
Bentuk molekul berkaitan dengan susunan
ruang atom-atom dalam molekul. Kita dapat menentukan bentuk molekul dari hasil
percobaan maupun dengan cara meramal.
1) Teori VSEPR (Valence Shell Electron Pair Repulsion)
Teori ini menyatakan bahwa pasangan elektron dalam ikatan kimia ataupun pasangan elektron yang tidak dipakai bersama (yaitu pasangan elektron “mandiri”) saling tolakmenolak, pasangan elektron cenderung untuk berjauhan satu sama lain. Teori ini menggambarkan arah pasangan elektron terhadap inti suatu atom. Gaya tolak-menolak antara dua pasang elektron akan semakin kuat dengan semakin kecilnya jarak antara kedua pasang elektron tersebut. Gaya tolakan akan menjadi semakin kuat jika sudut di antara kedua pasang elektron tersebut besarnya 90º. Selain itu, tolakan yang melibatkan pasangan elektron mandiri lebih kuat daripada yang melibatkan pasangan ikatan.
2) Teori Domain Elektron
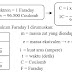
Teori domain elektron adalah suatu cara meramalkan bentuk molekul berdasarkan tolak-menolak elektron-elektron pada kulit luar atom pusat. Domain elektron berarti daerah keberadaan elektron.
Jumlah domain
elektron ditentukan:
1. Setiap Setiap elektron ikatan
(baik itu tunggal, atau rangkap) berarti 1 domain.
2. Setiap pasangan elektron
bebas berarti 1 domain.
b. Urutan kekuatan tolak-menolak di antara domain elektron adalah: tolakan antardomain elektron bebas > tolakan antara domain elektron bebas dengan domain elektron ikatan > tolakan antardomain elektron ikatan. Perbedaan daya tolak ini terjadi karena pasangan elektron bebas hanya terikat pada satu atom saja, sehingga bergerak lebih leluasa dan menempati ruang lebih besar daripada pasangan elektron ikatan. Akibat dari perbedaan daya tolak tersebut adalah mengecilnya sudut ikatan karena desakan dari pasangan elektron bebas. Hal ini juga terjadi dengan domain yang mempunyai ikatan rangkap atau rangkap tiga, yang pasti mempunyai daya tolak lebih besar daripada domain yang hanya terdiri dari sepasang elektron.
c. Bentuk molekul hanya ditentukan oleh pasangan elektron terikat.
Jumlah domain (pasangan elektron) dalam suatu molekul dapat dinyatakan sebagai berikut.
• Atom pusat dinyatakan dengan lambang A.
• Domain elektron ikatan dinyatakan dengan X.
• Domain elektron bebas dinyatakan dengan E.
Tipe molekul dapat dinyatakan dengan menggunakan langkah-langkah sebagai berikut.
1) Menentukan jumlah elektron valensi atom pusat (EV).
2) Menentukan jumlah domain elektron ikatan (X).
3) Menentukan jumlah domain elektron bebas (E).
1) tipe molekul BF3
Jumlah elektron valensi
atom pusat (boron) = 3
Jumlah
domain elektron ikatan (X) = 3
Jumlah domain elektron bebas (E)
= ![]() = 0
= 0
Tipe
molekul: AX3.
2) tipe molekul PCl3
Jumlah elektron valensi atom pusat (fosfor) = 5
Jumlah domain elektron ikatan (X) = 3
Tipe molekul: AX3E
3) tipe molekul ClF3
Jumlah elektron valensi atom pusat (klorin) = 7
Jumlah domain elektron ikatan (X) = 3
Tipe molekul: AX3E2- Budi Utami, dkk., 2009, Kimia untuk SMA/MA Kelas XI, Pusat Perbukuan Depdiknas, Jakarta
Brady, James, 1990, General Chemistry, Fifth Edition, New York, John Wiley & Sons, Inc.
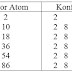
1. Perkirakan bentuk molekul dari:
a. SF4 (nomor
atom S = 16, F = 9)
b. PCl5 (nomor
atom P = 15, Cl = 17)
c. SeO2 (nomor
atom Se = 34, O = 8)
d. TiO2 (nomor
atom Ti = 22, O = 8)
e. SO3 (nomor
atom S = 16, O = 8)