Tatanama Aldehid dan Keton
Tatanama Aldehid dan Keton
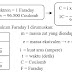
1. Aldehid (Alkanal)
Aldehid atau alkanal adalah senyawa turunan alkana dengan gugus
fungsi ![]() . Rumus struktur aldehid adalah
. Rumus struktur aldehid adalah ![]()
a. Rumus Umum
Perhatikan rumus struktur beberapa aldehid pada tabel berikut.