HAKIKAT ILMU KIMIA
Maya Mutiasari
Juli 27, 2020
0 Comments
PENDAHULUAN
TUJUAN PEMBELAJARAN
Setelah mempelajari materi ini, siswa diharapkan mampu:
- Memahami ilmu kimia dan peranannya
- Memahami karakteristik ilmu kimia
- Menerapkan prinsip-prinsip metode ilmiah untuk memahami fenomena kimia di sekitar
- Menjelaskan materi dan klasifikasinya
- Menggunakan peralatan di laboratorium secara tepat
ILMU KIMIA DAN PERANANNYA
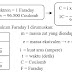
Peta Konsep
Ilmu kimia adalah cabang dari ilmu pengetahuan alam yang mempelajari tentang struktur dan sifat materi (zat), perubahan materi dan energi yang menyertai perubahan materi.Hakikat ilmu kimia adalah suatu benda dapat mengalami perubahan bentuk maupun susunan partikelnya menjadi bentuk lain sehingga dapat memengaruhi sifatnya.
Untuk lebih jelasnya, coba amati tayangan video berikut!
Ilmu kimia merupakan pusat dari ilmu pengetahuan, karena ilmu kimia dibutuhkan dalam mempelajari ilmu pengetahuan lainnya, misalnya biologi, fisika, geografi, kesehatan, kedokteran, geologi, dan bahkan bidang hukum juga membutuhkan ilmu kimia.
Berikut ini contoh peranan ilmu kimia terhadap bidang ilmu lain:
1. Kesehatan dan Kedokteran
– Pembuatan obat-obatan
– Pembuatan vaksin
– Pembuatan cairan infus
– Alat Rontgen
– Sterilisasi alat-alat kedokteran
2. Teknologi Pangan dan Pertanian
– Pembuatan pupuk
– Pembutan bibit unggul
– Pembuatan pestisida
– Penentuan tingkat keasaman tanah
– Penggunaan mikroorganisme/bakteri pada pengolahan makanan,
misalnya pada pembuatan kecap, tempe, roti, yoghurt
– Penggunaan zat aditif makanan misalnya pengawet, pewarna, penguat rasa
3. Energi dan Lingkungan
– Pengolahan minyak bumi
– Pembangkit listrik tenaga nuklir
– Pembuatan sel surya
– Pembuatan baterai
– Pengolahan limbah pabrik
4. Geologi
– Penentuan usia fossil
5. Hukum
– Tes DNA pelaku kejahatan
– Uji forensik
Metode Ilmiah
Penting bagi
ilmuwan untuk memahami metode ilmiah yang baik dan benar. Gagasan yang mereka
usulkan hanya bisa terjawab melalui metode ilmiah. Adapun langkah-langkah yang
harus dilakukan dalam metode ilmiah adalah sebagai berikut.
- Merumuskan masalah dengan cara
fokus pada bahasan tertentu atau tema tertentu.
- Mengkaji teori atau penelitian
sebelumnya yang bertujuan untuk menghindari tumpang tindih penelitian.
Artinya, jangan sampai penelitian yang dilakukan ternyata sudah pernah
dilakukan sebelumnya oleh orang lain.
- Mengajukan hipotesis bertujuan
untuk mendapatkan kesimpulan sementara berdasarkan analisis yang telah
dilakukan.
- Melakukan eksperimen untuk menguji
hipotesis.
- Mengumpulkan data.
- Mengolah dan menganalisis
data-data hasil penelitian.
- Membuat kesimpulan.
- Melaporkan hasil penelitian dalam
bentuk laporan ilmiah. (Sumber: https://www.quipper.com/id/blog/mapel/kimia/hakikat-ilmu-kimia-kimia-kelas-10/)
Manfaat Mempelajari Kimia
Jangan
menganggap bahwa ilmu Kimia hanya digunakan sebagai sarana untuk mendapatkan
nilai di sekolah. Lebih dari itu, banyak manfaat yang bisa Quipperian dapatkan
dengan mempelajari Kimia. Apa saja manfaatnya?
- Memahami alam
beserta prosesnya, sebagai contoh saat bernapas oksigen akan masuk ke
dalam tubuh. Di dalam tubuh, oksigen akan mengalami proses pembakaran agar
dihasilkan energi.
- Memahami
produk-produk yang berguna dalam kebutuhan sehari-hari, contohnya
detergen, sabun, obat-obatan, dan sebagainya.
- Memahami
berbagai jenis produk teknologi, contohnya pesawat terbang, mobil, kulkas,
dan sebagainya.
- Memahami
produk Kimia yang dapat menimbulkan masalah, contohnya DDT, CFC,
unsur-unsur radioaktif, dan merkuri.
- Memahami
bahan-bahan Kimia beracun, contohnya formalin. (Sumber: https:// www.quipper. com/id/blog/mapel/kimia/hakikat-ilmu-kimia-kimia-kelas-10/)