LARUTAN ELEKTROLIT
Masih ingatkah
Anda, apakah larutan itu? Tentunya Anda masih ingat bukan? Larutan adalah
campuran yang bersifat homogen atau serba sama. Jika Anda melarutkan 2 sendok
makan gula putih (pasir) ke dalam segelas air, maka Anda telah mendapatkan
larutan gula. Cobalah Anda ingat kembali, manakah dari gula dan air yang
berperan sebagai zat terlarut dan zat pelarut.
Larutan adalah campuran homogen dua zat atau lebih yang saling
melarutkan dan masing-masing zat penyusunnya tidak dapat dibedakan lagi secara
fisik.
Larutan terdiri atas dua komponen, yaitu komponen zat terlarut dan
pelarut.
·
Komponen
dengan jumlah yang sedikit biasanya dinamakan zat terlarut.
·
Pelarut
adalah komponen
yang jumlahnya lebih banyak atau yang strukturnya tidak berubah.
Di SMP atau bahkan di SD Anda pernah
membedakan benda-benda yang dapat menghantarkan listrik atau tidak dapat
menghantarkan listrik, melalui percobaan berikut.
Setelah diamati
percobaan seperti di atas, kita dapat membedakan benda yang dapat
menghantarkan listrik dengan lampu menyala. Sedangkan benda yang tidak
menghantarkan listrik lampunya padam. Ternyata paku dapat menghantarkan listrik
sedangkan plastik tidak menghantarkan
listrik.
B. Perbedaan Larutan Berdasarkan Daya Hantar
Listrik
Berdasarkan daya hantar listriknya, larutan terbagi menjadi 2 golongan yaitu larutan elektrolit
dan larutan non elektrolit.
1.
Larutan Elektrolit
Elektrolit
berasal dari katan bahasa Yunani yang berarti ‘pembawa lsitrik’. Larutan
elektrolit dapat menghantarkan arus listrik karena mengandung ion-ion yang
bergerak bebas. Ion-ion itu berperan menghantarkan arus listrik melalui larutan.
Contoh larutan elektrolit adalah NaCl, HCl, CH3COOH dan H2SO4.
Pada larutan elektrolit yang dilengkapi elektroda dan rangkaian listrik,
ion-ion negatifnya (anion) bergerak menuju elektroda yang bermuatan positif
(anoda) dan melepaskan electron. Sedangkan ion-ion positif (kation) bergerak
menuju elektroda yang bermuatan negative (katoda) dan mengambil elektron.
2.
Larutan Non-elektrolit
Larutan non-elektrolit merupakan kebalikan dari larutan elektrolit.
Larutan ini tidak mampu menghantarkan arus listrik karena pada saat berupa
larutan, tidak ada ion-ion yang bergerak bebas di dalamnya.
Adapun
jenis ikatan yang dimiliki oleh larutan non-elektrolit adalah ikatan kovalen.
Ikatan kovalen terbentuk karena pemakaian bersama pasangan electron. Ketika
berada dalam larutan, senyawa kovalen tidak mengalami ionisasi, sehingga tidak
ada ion-ion yang dapat menghantarkan arus listrik. Contoh larutan
non-elektrolit adalah larutan gula, larutan urea, larutan alkohol.
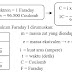
C. Pengelompokkan Larutan Berdasarkan Jenisnya
Larutan dapat dibagi menjadi larutan
elektrolit dan non elektrolit. Sedangkan elektrolit dapat dikelompokkan menjadi
larutan elektrolit kuat dan elektrolit lemah sesuai skema penggolongan berikut.
Ion-ion yang terdapat dalam
larutan elektrolit karena dalam larutan senyawanya mengalami peruraianyang
dikenal sebagai proses ionisasi.
Proses ionisasi ada yang sempurna dan ada pula yang hanya sebagian. Contoh
ionisasi sempurna dapat terjadi pada larutan HCl.
Reaksi ionisasi HCl dalam
larutannya, yaitu:
HCl
(aq) → H+(aq) + Cl-(aq)
Reaksi
penguaraian ini disebut elektrolisis.
Besaran yang menandai kekuatan suatu elektrolit yang disebut derajat ionisasi (α). Besarnya derajat
ionisasi dinyatakan dengan persamaan berikut:
Pada larutan
ionisasi asam asetat, yaitu : CH3COOH D H++
CH3COO- , penggunaan panah dua arah ini menyatakan bahwa
kecepatan reaksi dari kiri ke kanan adalah sama dengan kecepatan reaksi dari
kanan ke kiri. Hal ini menunjukkan bahwa hanya sebagian kecil asam asetat yang
terionisasi. Sehingga daya hantar listrik asam asetat kecil.
D.
Pengelompokan Larutan Elektrolit Berdasarkan
Ikatannya
1.
Senyawa Kovalen Polar
Senyawa kovalen polar terjadi karena adanya
penggunaan bersama pasangan elektron antara dua atom non-logam yang memiliki
keelektronegatifan yang besar. Molekul-molekul senyawa kovalen polar dapat
diuraikan oleh air membentuk ion positif dan ion negative yang bergerak bebas
sehingga dapat menghantarkan listrik. Larutan elektrolit ini meliputi
senyawa-senyawa asam, misalnya:
a) Asam klorida (HCl)
Asam klorida
terionisasi sesuai reaksi sbb:
HCl(l) + H2O(l)
→ H3O+(aq) + Cl-(aq)
b) Natrium klorida (NaOH)
Natrium klorida
terionisasi sesuai reaksi sbb:
NaOH(s) + H2O(l)
→ Na+(aq) + H3O+(l)
2. Senyawa
Ion
Senyawa
ion terdiri atas atom logam dan non-logam. Jika dilarutkan dalam air,
ion-ion yang terikat kuat dalam zat padat
akan lepas dan dapat bergerak bebas satu dengan yang lainnya. Dengan adanya
ion-ion bebas inilah, maka larutan dapat menghantarkan arus listrik.
Kristal senyawa ion tidak dapat menghantarkan
listrik, karena ion-ion tersebut tidak dapat bergerak bebas. Sementara, jika
senyawa ion dipanaskan hingga meleleh, ion-ion tersebut dapat bergerak bebas
sehingga lelehan senyawa ion juga dapat menghantarkan listrik. Larutan
elektrolit jenis ini meliputi beberapa senyawa berikut, antara lain:
a) Natrium klorida (NaCl)
Natrium klorida
terionisasi sesuai reaksi berikut:
NaCl(aq)
→ Na+(aq) + Cl-(aq)
b) Magnesium klorida (MgCl2)
Magnesium
klorida terionisasi sesuai reaksi berikut:
MgCl2(aq) → Mg2+(aq)
+ 2Cl-(aq)
Untuk lebih
jelas lagi tentang hubungan sifat elektrolit dengan ikatan kimia, silakan
perhatikan bagan berikut:



















83 komentar:
Nama : Irfan Mulyana
Kelas: X MIPA 4
Jawaban
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. a. logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya
Merry desima sihite
X MIPA 1
Jawaban
1
a)golongan zat murni yang dapat menghantarkan listrik adalah golongan cair
b)senyawa ion yaitu kalium dan klorida
senyawa kovalen yaitu bromin,air,asam cuka,etanol,gula dan asam sulfat
c)a)jenis elektrolit=senyawa ion
padatan=non konduktor
lelehan=konduktor
larutan=konduktor
b)jenis elektorlit=senyawa kovalen
padatan=nonkonduktor
lelehan=non konduktor
larutan=konduktor
2
a.logam aluminium=dapat karena bersifat konduktor
b. aluminium cair=dapat karena cairan juga konduktor
c. klorin NaCl=tdk dpt karena bersifat isolator
d. Kristal NaCl=tdk dapat karena bersifat isolator listrik
e. lelehan NaCl=dapat karena bersifat konduktor listrik
f. larutan NaCl:dapat,bersifat konduktorsegala cairan
g. lelehan asam asetat murni=dapat karena berupa lelehan yang bersifat konduktor
h. larutan asam asetat=dapat,karena berupa larutan
i. kristal gula=tdk dapat karena isolator listrik
j. larutan gula=dapat=karena berupa larutan
Nama : Tiara Elyza Agesti
Kelas: X MIPA 1
Jawaban
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. a. logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya
Nama : Indi Candra Winata
Kelas : X MIPA 4
1. . A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. jika beserta alasannya
a. logam aluminium=dapat karena bersifat konduktor
b. aluminium cair=dapat karena cairan juga konduktor
c. klorin NaCl=tdk dpt karena bersifat isolator
d. Kristal NaCl=tdk dapat karena bersifat isolator listrik
e. lelehan NaCl=dapat karena bersifat konduktor listrik
f. larutan NaCl:dapat,bersifat konduktorsegala cairan
g. lelehan asam asetat murni=dapat karena berupa lelehan yang bersifat konduktor
h. larutan asam asetat=dapat,karena berupa larutan
i. kristal gula=tdk dapat karena isolator listrik
j. larutan gula=dapat=karena berupa larutan
Nama:Diah ayu Safitri
Kelas:X MIPA 1
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. a. logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya
Jawaban
Nama: Anyelir Yuni Azahra
Kelas: X MIPA 3
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida.
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat.
C. Jenis elektrolit=senyawa ion
Padatan=non konduktor
Lelehan=konduktor
Larutan=konduktor.
D. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai
larutann&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki
titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik &
cairannyaa tidak.
2. A.logam aluminium = merupakan logam sehingga dapat menghantarkan listrik.
B.Aluminium cair = dapat menghantarkan listrik.
C.Klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas
hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus
listrikk karena gas klorin merupakan senyawa kovalen non polar.
D.Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL
memilikii kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak
dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion
didalamnya.
E.Lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya
burukk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian
sehinggaa hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus
listrik.
F.Larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion -
ionn dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat
bebas.
G.Lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan
senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama
sekali tidak ada yang terurai.
H.Larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus
litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya.
Nama: Winny Kafka Nafisa
Kelas: X MIPA 3
Hari/Tanggal: Senin 25 Januari 2021
1.A.Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
b.Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
c.Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2.A.logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya
Nama : Muhammad Gifar Qodri
Kelas: X MIPA 4
1. A.Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C.perbedaan antara elektrolik senyawa ion dan elektrolit senya
2.a. logam aluminium=dapat karena bersifat konduktor
b. aluminium cair=dapat karena cairan juga konduktor
c. klorin NaCl=tdk dpt karena bersifat isolator
d. Kristal NaCl=tdk dapat karena bersifat isolator listrik
e. lelehan NaCl=dapat karena bersifat konduktor listrik
f. larutan NaCl:dapat,bersifat konduktorsegala cairan
g. lelehan asam asetat murni=dapat karena berupa lelehan yang bersifat konduktor
h. larutan asam asetat=dapat,karena berupa larutan
i. kristal gula=tdk dapat karena isolator listrik
j. larutan gula=dapat=karena berupa larutan
Nama:putri awaliyah ramadhani
Kelas:xmipa3
1. . A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. jika beserta alasannya
a. logam aluminium=dapat karena bersifat konduktor
b. aluminium cair=dapat karena cairan juga konduktor
c. klorin NaCl=tdk dpt karena bersifat isolator
d. Kristal NaCl=tdk dapat karena bersifat isolator listrik
e. lelehan NaCl=dapat karena bersifat konduktor listrik
f. larutan NaCl:dapat,bersifat konduktorsegala cairan
g. lelehan asam asetat murni=dapat karena berupa lelehan yang bersifat konduktor
h. larutan asam asetat=dapat,karena berupa larutan
i. kristal gula=tdk dapat karena isolator listrik
j. larutan gula=dapat=karena berupa larutan
Nama: DINIAH AFRIYANI
Kelas : X IPA 2
1) a.golongan zat murni yang dapat menghantarkan listrik adalah golongan cair
b.senyawa ion yaitu kalium dan klorida
senyawa kovalen yaitu bromin,air,asam cuka,etanol,gula dan asam sulfat
c.a)jenis elektrolit=senyawa ion
padatan=non konduktor
lelehan=konduktor
larutan=konduktor
b)jenis elektorlit=senyawa kovalen
padatan=nonkonduktor
lelehan=non konduktor
larutan=konduktor
2) a.logam aluminium=dapat karena bersifat konduktor
b. aluminium cair=dapat karena cairan juga konduktor
c. klorin NaCl=tdk dpt karena bersifat isolator
d. Kristal NaCl=tdk dapat karena bersifat isolator listrik
e. lelehan NaCl=dapat karena bersifat konduktor listrik
f. larutan NaCl:dapat,bersifat konduktorsegala cairan
g. lelehan asam asetat murni=dapat karena berupa lelehan yang bersifat konduktor
h. larutan asam asetat=dapat,karena berupa larutan
i. kristal gula=tdk dapat karena isolator listrik
j. larutan gula=dapat=karena berupa larutan
Nama:Aqilah zaharah
Kelas:X MIPA 2
A)golongan zat murni yang dapat menghantarkan listrik adalah golongan cair
B)senyawa ion yaitu kalium dan klorida
senyawa kovalen yaitu bromin,air,asam cuka,etanol,gula dan asam sulfat
C)•jenis elektrolit=senyawa ion
padatan=non konduktor
Lelehan=konduktor
larutan=konduktor
•jenis elektorlit=senyawa kovalen
padatan=nonkonduktor
lelehan=non konduktor
larutan=konduktor
D)Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai
larutann&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki
titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik &
cairannyaa tidak.
2.a.logam aluminium=dapat karena bersifat konduktor
b. aluminium cair=dapat karena cairan juga konduktor
c. klorin NaCl=tdk dpt karena bersifat isolator
d. Kristal NaCl=tdk dapat karena bersifat isolator listrik
e. lelehan NaCl=dapat karena bersifat konduktor listrik
f. larutan NaCl:dapat,bersifat konduktorsegala cairan
g. lelehan asam asetat murni=dapat karena berupa lelehan yang bersifat konduktor
h. larutan asam asetat=dapat,karena berupa larutan
i. kristal gula=tdk dapat karena isolator listrik
j. larutan gula=dapat=karena berupa larutan
NAMA: NURAJIJAH
KELAS : X MIPA 4
JAWABAN
1).A. Golongan zat Murni yang dapat menghantarkan listrik adalah golongan cair
B. Senyawa ion : Kalium klorida.
Senyawa kovalen : bromin, air, asam cuka, etanol, gula, asam sulfat.
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan
Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2). a. logam aluminium=dapat karena bersifat konduktor
b. aluminium cair=dapat karena cairan juga konduktor
c. klorin Cair =tdk dpt karena bersifat isolator
d. Kristal NaCl=tdk dapat karena bersifat isolator listrik
e. lelehan NaCl=dapat karena bersifat konduktor listrik
f. larutan NaCl:dapat,bersifat konduktorsegala cairan
g. lelehan asam asetat murni=dapat karena berupa lelehan yang bersifat konduktor
i. kristal gula=tdk dapat karena isolator listrik
j. larutan gula=dapat=karena berupa larutan
NAMA : HANIFAH
Kelas : X MIPA 1
JAWABAN
1).A. Golongan zat murni yang dapat menghantarkan listrik adalah golongan cair.
B. Senyawa ion:kalium klorida
Senyawa kovalen:bromin,air,asam,cuka,etanol,gula,asam sulfat.
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai.
larutan&cairan yg menghantarkan listrik sedangkan
Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja.
Yang menghantar listrik & cairannya tidak.
2).a. logam aluminium=dapat karena bersifat konduktor
b. aluminium cair=dapat karena cairan juga konduktor
c. klorin cair=tdk dpt karena bersifat isolator
d. Kristal NaCl=tdk dapat karena bersifat isolator listrik
e. lelehan NaCl=dapat karena bersifat konduktor listrik
f. larutan NaCl:dapat,bersifat konduktorsegala cairan
g. lelehan asam asetat murni=dapat karena berupa lelehan yang bersifat konduktor
i. kristal gula=tdk dapat karena isolator listrik
j. larutan gula=dapat=karena berupa larutan
NAMA : MAHARANI
Kelas : X MIPA 1
JAWABAN
1).A. Golongan zat murni yang dapat menghantarkan listrik adalah golongan cair.
B. Senyawa ion:kalium klorida
Senyawa kovalen:bromin,air,asam,cuka,etanol,gula,asam sulfat.
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai.
larutan&cairan yg menghantarkan listrik sedangkan
Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja.
Yang menghantar listrik & cairannya tidak.
2).a. logam aluminium=dapat karena bersifat konduktor
b. aluminium cair=dapat karena cairan juga konduktor
c. klorin cair=tdk dpt karena bersifat isolator
d. Kristal NaCl=tdk dapat karena bersifat isolator listrik
e. lelehan NaCl=dapat karena bersifat konduktor listrik
f. larutan NaCl:dapat,bersifat konduktorsegala cairan
g. lelehan asam asetat murni=dapat karena berupa lelehan yang bersifat konduktor
i. kristal gula=tdk dapat karena isolator listrik
j. larutan gula=dapat=karena berupa larutan
24 Januari 2021 17.09
NAMA :Sekar Puspita Arum
Kelas : X MIPA 1
JAWABAN
1).A. Golongan zat murni yang dapat menghantarkan listrik adalah golongan cair.
B. Senyawa ion:kalium klorida
Senyawa kovalen:bromin,air,asam,cuka,etanol,gula,asam sulfat.
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai.
larutan&cairan yg menghantarkan listrik sedangkan
Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja.
Yang menghantar listrik & cairannya tidak.
2).a. logam aluminium=dapat karena bersifat konduktor
b. aluminium cair=dapat karena cairan juga konduktor
c. klorin cair=tdk dpt karena bersifat isolator
d. Kristal NaCl=tdk dapat karena bersifat isolator listrik
e. lelehan NaCl=dapat karena bersifat konduktor listrik
f. larutan NaCl:dapat,bersifat konduktorsegala cairan
g. lelehan asam asetat murni=dapat karena berupa lelehan yang bersifat konduktor
i. kristal gula=tdk dapat karena isolator listrik
j. larutan gula=dapat=karena berupa larutan
kiNama:Dimas Saputra
Kelas:X Mipa 1
1.A.Golongan zat murni yang dapat menghantarkan listrik adalah golongan cair.namun tidak semua golongan cair dapat menghantar kan listrik contoh golongan cair yg dapat menghantar kan lisktir adalh Raksa,Zink Cair,kalium Klorida Cair
B.Senyawa Ion:Kalium Klorida
Senyawa kovalen:bromin,air,asam cuka,etanol,gula dan asam sulfat
C.Perbedaanya terjadi pada titik didih,Ikatan ion,dan elektron.
Untuk senyawa ion cenderung memilik titi didih dan ikatan ion yang lebih kuat serta eletron yang diberikan satu atom unsur kpd unsur lainya.Sedankan kovalen titik didih dan ikatan ion lemah ,serta elektron yang digunakan bersama sma oleh beberapa atom.
2).a. logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya
Untuk i. kristal gula dan j. larutan gula = tidak dapat mengahantarkan arus listrik, merupakan senyawa kovalen non polar, dan tidak ada ion - ion yang terurai dalam krital ataupun dalam bentuk larutannya,
Nama: fajrullah
Kelas: MIPA 3
1.A.Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B.Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C.untuk perbedaan terjadi pada daya hantar listrik & titik didihnya.
Dan juga untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2.a.logam aluminium = merupakan logam yang dapat menghantarkan listrik
b.aluminium cair = dapat menghantarkan listrik
c.klorin NaCl = jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d.Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e.lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f.larutan NaCl = justru sebaliknya bisa mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g.lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h.larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya
Maaf pak/buk jika jawaban nya sama dengan yg lain saya minta maaf
Karana memang gitu.
Nama: Mustika Chandra Kirana
Kelas:X MIPA 3
1. a). golongan zat murni yang dapat menghantarkan listrik adalah golongan cair
b). senyawa ion=kalium klorida
senyawa kovalen=bromin,air,asam cuka,etanol,gula,asam sulfat.
c). senyawa ion= bentuk padatan:non konduktor
bentuk lelehan:konduktor
bentuk larutan:konduktor
senyawa kovalen= bentuk padatan: non konduktor
bentuk lelehan: non konduktor
bentuk larutan: konduktor
2. -logam aluminium:bisa,karena bersifat konduktor
-aluminium cair:bisa,karena cairan bersifat konduktor
-klorin cair:tidak bisa,karena bersifat isolator
-kristal NaCL:tidak bisa,karena bersifat isolator listrik
-lelehan NaCL:bisa,karena konduktor listrik
-larutan NaCL:bisa,karena konduktor segala cairan
-lelehan asam asetat murni:bisa,karena beruoa lelehan yang bersifat konduktor
-larutan asam asetat:bisa,karena berupa larutan
-kristal gula:tidak bisa,karena bersifat isolator listrik
-larutan gula:bisa,karena berupa larutan
Nama:Dimas Saputra
Kelas:X Mipa 1
1.A.Golongan zat murni yang dapat menghantarkan listrik adalah golongan cair.namun tidak semua golongan cair dapat menghantar kan listrik contoh golongan cair yg dapat menghantar kan lisktir adalh Raksa,Zink Cair,kalium Klorida Cair
B.Senyawa Ion:Kalium Klorida
Senyawa kovalen:bromin,air,asam cuka,etanol,gula dan asam sulfat
C.Perbedaanya terjadi pada titik didih,Ikatan ion,dan elektron.
Untuk senyawa ion cenderung memilik titi didih dan ikatan ion yang lebih kuat serta eletron yang diberikan satu atom unsur kpd unsur lainya.Sedankan kovalen titik didih dan ikatan ion lemah ,serta elektron yang digunakan bersama sma oleh beberapa atom.
2).a. logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya
Untuk i. kristal gula dan j. larutan gula = tidak dapat mengahantarkan arus listrik, merupakan senyawa kovalen non polar, dan tidak ada ion - ion yang terurai dalam kristal ataupun dalam bentuk larutannya,
Nama : intan nur purnamasari
Kelas : X MIPA 3
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. a. logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya
Nama: Sri Yuliani
Kelas:X MIPA 1
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. a. logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya
Nama : RIZKA ERAWATI
Kls : X MIPA 1
Senin,25 januari 2021
Jawaban:
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. a. logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya
Nama ; Nurul Hasanah
Kelas : X MIPA 4
Jawaban :
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. a. logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya
Nama:Meisi Listya
Kelas:X MIPA 3
Jawaban
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. a. logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya.
Senin,25 januari 2021
Nama : Sarkani
Kelas: X MIPA 4
Jawaban
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. a. logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya
24 Januari 2021 08:14
Nama:Dinda Agustyanah
Kelas:X MIPA 1
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair yaitu raksa,zink cair,kalium klorida cair.
B. -Senyawa ion : kalium klorida
-Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2.a. logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl(cair)=jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya
Untuk i. kristal gula dan j. larutan gula = tidak dapat mengahantarkan arus listrik, merupakan senyawa kovalen non polar, dan tidak ada ion - ion yang terurai dalam krital ataupun dalam bentuk larutannya,
Nama: cheysha azura Ardi Safitri
Kelas: X MIPA 2
Jawaban
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. a. logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya
Nama:Aditia Nur Rizky
Kelas:MIPA 4
1. . A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. jika beserta alasannya
a. logam aluminium=dapat karena bersifat konduktor
b. aluminium cair=dapat karena cairan juga konduktor
c. klorin NaCl=tdk dpt karena bersifat isolator
d. Kristal NaCl=tdk dapat karena bersifat isolator listrik
e. lelehan NaCl=dapat karena bersifat konduktor listrik
f. larutan NaCl:dapat,bersifat konduktorsegala cairan
g. lelehan asam asetat murni=dapat karena berupa lelehan yang bersifat konduktor
h. larutan asam asetat=dapat,karena berupa larutan
i. kristal gula=tdk dapat karena isolator listrik
j. larutan gula=dapat=karena berupa larutan
Nama: Latifah Hisanunnisa
Kelas: X MIPA 1
Jawaban
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. a. logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya.
NAMA: SITI FARAH NUR MAULIDA
KELAS: X MIPA 2
JAWABAN:
1. A. Golongan zat murni yang dapat menghantarkan listrik adlaah golongan cair.
B. Senyawa ion: kalium klorida.
Senyawa kovalen: bromin, air, asam cuka, etanol, gula, asam sulfat.
C. Perbedaan antara elektrolit senyawa ion dengan elektrolit senyawa kovalen (polar) disimpulkan sebagai berikut.
•Jenis elektrolit. •Padatan.
-Senyawa kovalen. -non konduktor.
-Senyawa kovalen. -non konduktor.
•Lelehan. •Larutan.
-konduktor. -konduktor.
-non konduktor. -konduktor.
2. a. logam aluminium=dapat karena bersifat konduktor
b. aluminium cair=dapat karena cairan juga konduktor
c. klorin NaCl=tdk dpt karena bersifat isolator
d. Kristal NaCl=tdk dapat karena bersifat isolator listrik
e. lelehan NaCl=dapat karena bersifat konduktor listrik
f. larutan NaCl:dapat,bersifat konduktorsegala cairan
g. lelehan asam asetat murni=dapat karena berupa lelehan yang bersifat konduktor
h. larutan asam asetat=dapat,karena berupa larutan
i. kristal gula=tdk dapat karena isolator listrik
j. larutan gula=dapat=karena berupa larutan
Nama : Harits Aidil Muzaki
Kelas: X MIPA 2
Jawaban
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. a. logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya
Nama : Deswita Indriyana
Kelas: X MIPA 2
1. A). Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B). Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C). Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. a. logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya.
Nama : Ismet Maulana Azhari
Kelas : X Mipa 1
1. A). Golongan zat murni yg dpt menghantarkan listrik adalah golongan cair
B). Senyawa ion : Kalium klorida
Senyawa kovalen : Bromin, air, asam cuka, etanol, gula, asam sulfat
C). 1). Senyawa ion
Padatan : Non konduktor
Lelehan : Konduktor
Larutan : Konduktor
2). Senyawa kovalen
Padatan : Non konduktor
Lelehan : Non konduktor
Larutan : Konduktor
2. a. logam aluminium = dapat menghantarkan arus listrik
b. aluminium cair = dapat menghantarkan arus listrik
c. klorin NaCl = jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik
d. Kristal NaCl = tidak dapat menghantarkan arus listrik
e. lelehan NaCl = dapat menghantarkan listrik tetapi daya hantar arus listriknya buruk.
f. larutan NaCl = dapat menghantarkan arus listrik
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah
i. kristal gula = tidak dapat menghantarkan arus listrik
j. larutan gula = tidak dapat mengahantarkan arus listrik
nama : annisa nur'arrifa
kelas : X MIPA 2
1. a. golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair, tetapi tidak semuanya dapat menghantarkan arus listrik. contoh golongan cair yang dapat mengantarkan arus listrik diantaranya adalah Raksa, Zink Cair, Kalium Klorida Cair.
b. –senyawa ion : Kalium klorida
–senyawa kovalen : Bromin, Air, Asam cuka, Etanol, Gula, dan Asam sulfat
c. perbedaannya terdapat pada daya hantar listrik dan titik didihnya.
untuk Senyawa ion cenderung mempunyai titik didih/leleh yangg tinggi, serta mempunyai larutan dan cairan yang dapat menghantarkan listrik, sedangkan Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yang dapat menghantar listrik, di cairannya tidak dapat.
2. a. Logam aluminium : merupakan jenis Logam sehingga dapat menghantarkan listrik
b. Aluminium cair = dapat menghantarkan listrik.
c. Klorin NaCl : disini Klorin dalam bentuk apa? jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka Klorin tidak dapat menghantarkan arus listrik karena gas Klorin merupakan senyawa Kovalen non polar.
d. Kristal NaCl : tidak dapat menghantarkan arus listrik dikarenakan padatan NaCl memiliki kerapatan yang sangat tinggi dan ion-ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya.
e. Lelehan NaCl : dapat menghantarkan listrik tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion-ionnya hanya terurai sebagian sehingga hanya sedikit dari ion-ion tersebut yang dapat menghantarkan arus listrik.
f. Larutan NaCl : dapat menghantarkan arus listrik dengan baik, dikarenakan ion-ion dalam larutannya terurai sempurna dan ion-ion tersebut bergerak sangat bebas.
g. Lelehan asam asetat murni : tidak dapat menghantarkan arus listrik, karena merupakan senyawa Kovalen polar, dalam fasa lelehan ion-ion di dalam asam asetat sama sekali tidak ada yang terurai.
h. Larutan asam asetat : dapat menghantarkan arus listrik tetapi daya hantar arus listriknya lemah, karena hanya sebagian ion-ion yang terurai dalam larutannya.
i. Kristal gula : tidak dapat mengahantarkan arus listrik, karena merupakan senyawa Kovalen non polar, dan tidak ada ion-ion yang terurai dalam kristal ataupun dalam bentuk larutannya.
j. Larutan gula : tidak dapat mengahantarkan arus listrik, dikarenakan merupakan senyawa Kovalen non polar, dan tidak ada ion - ion yang terurai dalam kristal ataupun dalam bentuk larutannya.
Nama : suci nur syahadatillah
Kelas: X MIPA 4
Jawaban
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. a. logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya
Nama: Nafidatuddiniah
Kelas:X MIPA 2
1.A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. a. logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya
24 Januari 2021 18.44
NAMA : VIENITA REVA
KELAS : X MIPA 2
1. a). Golongan zat murni yang dapat menghantar listrik adalah golongan cair.
b). Senyawa ion: Kalium klorida.
Senyawa kovalen: Bromin, air, asam cuka, etanol, gula, asam sulfat.
c). "Senyawa Ion"
Padatan : non konduktor
Lelehan : konduktor
Larutan : Konduktor
"Senyawa Kovalen"
Padatan : non konduktor
Lelehan : non konduktor
Larutan : Konduktor
2. a).Logam aluminium = merupakan logam sehingga dapat menghantarkan listrik karena bersifat konduktor.
b). Aluminium cair = dapat menghantarkan listrik karena konduktor.
c) . Klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar.
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCl memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya.
e). Lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik.
f) . Larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas.
g) . Lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai.
h). Larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutan.
i) kristal gula dan j) . larutan gula = tidak dapat mengahantarkan arus listrik, merupakan senyawa kovalen non polar, dan tidak ada ion - ion yang terurai dalam kristal ataupun dalam bentuk larutannya.
Nama: puput mutiara putri
Kelas:x MIPA 4
Jawaban
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. a. logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya
NAMA : AMANDA SALFFA LUKITA
KELAS: X MIPA 2
1. a). Golongan zat murni yang dapat menghantar listrik adalah golongan cair.
b). Senyawa ion: Kalium klorida.
Senyawa kovalen: Bromin, air, asam cuka, etanol, gula, asam sulfat.
c). "Senyawa Ion"
Padatan : non konduktor
Lelehan : konduktor
Larutan : Konduktor
"Senyawa Kovalen"
Padatan : non konduktor
Lelehan : non konduktor
Larutan : Konduktor
2. a).Logam aluminium = merupakan logam sehingga dapat menghantarkan listrik karena bersifat konduktor.
b). Aluminium cair = dapat menghantarkan listrik karena konduktor.
c) . Klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar.
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCl memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya.
e). Lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik.
f) . Larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas.
g) . Lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai.
h). Larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutan.
i) kristal gula dan j) . larutan gula = tidak dapat mengahantarkan arus listrik, merupakan senyawa kovalen non polar, dan tidak ada ion - ion yang terurai dalam kristal ataupun dalam bentuk larutannya.
1. a). Golongan zat murni yang dapat menghantar listrik adalah golongan cair.
b). Senyawa ion: Kalium klorida.
Senyawa kovalen: Bromin, air, asam cuka, etanol, gula, asam sulfat.
c). "Senyawa Ion"
Padatan : non konduktor
Lelehan : konduktor
Larutan : Konduktor
"Senyawa Kovalen"
Padatan : non konduktor
Lelehan : non konduktor
Larutan : Konduktor
2. a).Logam aluminium = merupakan logam sehingga dapat menghantarkan listrik karena bersifat konduktor.
b). Aluminium cair = dapat menghantarkan listrik karena konduktor.
c) . Klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar.
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCl memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya.
e). Lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik.
f) . Larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas.
g) . Lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai.
h). Larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutan.
i) kristal gula dan j) . larutan gula = tidak dapat mengahantarkan arus listrik, merupakan senyawa kovalen non polar, dan tidak ada ion - ion yang terurai dalam kristal ataupun dalam bentuk larutannya.
NAMA:RIDAMAULIDA
KELAS: X MIPA 2
25-01-2021
1. a). Golongan zat murni yang dapat menghantar listrik adalah golongan cair.
b). Senyawa ion: Kalium klorida.
Senyawa kovalen: Bromin, air, asam cuka, etanol, gula, asam sulfat.
c). "Senyawa Ion"
Padatan : non konduktor
Lelehan : konduktor
Larutan : Konduktor
"Senyawa Kovalen"
Padatan : non konduktor
Lelehan : non konduktor
Larutan : Konduktor
2. a).Logam aluminium = merupakan logam sehingga dapat menghantarkan listrik karena bersifat konduktor.
b). Aluminium cair = dapat menghantarkan listrik karena konduktor.
c) . Klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar.
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCl memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya.
e). Lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik.
f) . Larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas.
g) . Lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai.
h). Larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutan.
i) kristal gula dan j) . larutan gula = tidak dapat mengahantarkan arus listrik, merupakan senyawa kovalen non polar, dan tidak ada ion - ion yang terurai dalam kristal ataupun dalam bentuk larutannya.
NAMA:RIDAMAULIDA
KELAS: X MIPA 2
25-01-2021
1. a). Golongan zat murni yang dapat menghantar listrik adalah golongan cair.
b). Senyawa ion: Kalium klorida.
Senyawa kovalen: Bromin, air, asam cuka, etanol, gula, asam sulfat.
c). "Senyawa Ion"
Padatan : non konduktor
Lelehan : konduktor
Larutan : Konduktor
"Senyawa Kovalen"
Padatan : non konduktor
Lelehan : non konduktor
Larutan : Konduktor
2. a).Logam aluminium = merupakan logam sehingga dapat menghantarkan listrik karena bersifat konduktor.
b). Aluminium cair = dapat menghantarkan listrik karena konduktor.
c) . Klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar.
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCl memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya.
e). Lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik.
f) . Larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas.
g) . Lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai.
h). Larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutan.
i) kristal gula dan j) . larutan gula = tidak dapat mengahantarkan arus listrik, merupakan senyawa kovalen non polar, dan tidak ada ion - ion yang terurai dalam kristal ataupun dalam bentuk larutannya.
NAMA:RIDAMAULIDA
KELAS: X MIPA 2
25-01-2021
1. a). Golongan zat murni yang dapat menghantar listrik adalah golongan cair.
b). Senyawa ion: Kalium klorida.
Senyawa kovalen: Bromin, air, asam cuka, etanol, gula, asam sulfat.
c). "Senyawa Ion"
Padatan : non konduktor
Lelehan : konduktor
Larutan : Konduktor
"Senyawa Kovalen"
Padatan : non konduktor
Lelehan : non konduktor
Larutan : Konduktor
2. a).Logam aluminium = merupakan logam sehingga dapat menghantarkan listrik karena bersifat konduktor.
b). Aluminium cair = dapat menghantarkan listrik karena konduktor.
c) . Klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar.
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCl memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya.
e). Lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik.
f) . Larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas.
g) . Lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai.
h). Larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutan.
i) kristal gula dan j) . larutan gula = tidak dapat mengahantarkan arus listrik, merupakan senyawa kovalen non polar, dan tidak ada ion - ion yang terurai dalam kristal ataupun dalam bentuk larutannya.
NAMA:RIDAMAULIDA
KELAS: X MIPA 2
25-01-2021
Nama : Amelia Gita Cahyani
kelas : X MIPA 4
1. a). Golongan zat murni yang dapat menghantar listrik adalah golongan cair.
b). Senyawa ion: Kalium klorida.
Senyawa kovalen: Bromin, air, asam cuka, etanol, gula, asam sulfat.
c). "Senyawa Ion"
Padatan : non konduktor
Lelehan : konduktor
Larutan : Konduktor
"Senyawa Kovalen"
Padatan : non konduktor
Lelehan : non konduktor
Larutan : Konduktor
2. a).Logam aluminium = merupakan logam sehingga dapat menghantarkan listrik karena bersifat konduktor.
b). Aluminium cair = dapat menghantarkan listrik karena konduktor.
c) . Klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar.
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCl memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya.
e). Lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik.
f) . Larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas.
g) . Lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai.
h). Larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutan.
i) kristal gula dan j) . larutan gula = tidak dapat mengahantarkan arus listrik, merupakan senyawa kovalen non polar, dan tidak ada ion - ion yang terurai dalam kristal ataupun dalam bentuk larutannya.
Nama: Sri Suhesti
Kelas: X MIPA 3
1. a). Golongan zat murni yang dapat menghantar listrik adalah golongan cair.
b). Senyawa ion: Kalium klorida.
Senyawa kovalen: Bromin, air, asam cuka, etanol, gula, asam sulfat.
c). "Senyawa Ion"
Padatan : non konduktor
Lelehan : konduktor
Larutan : Konduktor
"Senyawa Kovalen"
Padatan : non konduktor
Lelehan : non konduktor
Larutan : Konduktor
2. a).Logam aluminium = merupakan logam sehingga dapat menghantarkan listrik karena bersifat konduktor.
b). Aluminium cair = dapat menghantarkan listrik karena konduktor.
c) . Klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar.
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCl memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya.
e). Lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik.
f) . Larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas.
g) . Lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai.
h). Larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutan.
i) kristal gula dan j) . larutan gula = tidak dapat mengahantarkan arus listrik, merupakan senyawa kovalen non polar, dan tidak ada ion - ion yang terurai dalam kristal ataupun dalam bentuk larutannya.
nama:ilham bagus noviano
kelas:x mipa 2
1a. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
b;Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
c: Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. a. logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya
i.larutan gula = tidak dapat mengahantarkan arus listrik, merupakan senyawa kovalen non polar, dan tidak ada ion - ion yang terurai dalam kristal ataupun dalam bentuk larutannya
Nama : Dini Aminarti
kelas : x mipa 4
1.A.Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. jika beserta alasannya
a. logam aluminium=dapat karena bersifat konduktor
b. aluminium cair=dapat karena cairan juga konduktor
c. klorin NaCl=tdk dpt karena bersifat isolator
d. Kristal NaCl=tdk dapat karena bersifat isolator listrik
e. lelehan NaCl=dapat karena bersifat konduktor listrik
f. larutan NaCl:dapat,bersifat konduktorsegala cairan
g. lelehan asam asetat murni=dapat karena berupa lelehan yang bersifat konduktor
h. larutan asam asetat=dapat,karena berupa larutan
i. kristal gula=tdk dapat karena isolator listrik
j. larutan gula=dapat=karena berupa larutan
NAMA : NOFIKA FITRIYANI
KELAS : X MIPA 1
1. a). Golongan zat murni yang dapat menghantar listrik adalah golongan cair.
b). Senyawa ion: Kalium klorida.
Senyawa kovalen: Bromin, air, asam cuka, etanol, gula, asam sulfat.
c). "Senyawa Ion"
Padatan : non konduktor
Lelehan : konduktor
Larutan : Konduktor
"Senyawa Kovalen"
Padatan : non konduktor
Lelehan : non konduktor
Larutan : Konduktor
2. a).Logam aluminium = merupakan logam sehingga dapat menghantarkan listrik karena bersifat konduktor.
b). Aluminium cair = dapat menghantarkan listrik karena konduktor.
c) . Klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar.
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCl memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya.
e). Lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik.
f) . Larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas.
g) . Lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai.
h). Larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutan.
i) kristal gula dan j) . larutan gula = tidak dapat mengahantarkan arus listrik, merupakan senyawa kovalen non polar, dan tidak ada ion - ion yang terurai dalam kristal ataupun dalam bentuk larutannya.
Nama: Rifqi alfansah
Kelas: X MIPA 2
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida.
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat.
C. Jenis elektrolit=senyawa ion
Padatan=non konduktor
Lelehan=konduktor
Larutan=konduktor.
D. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai
larutann&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki
titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik &
cairannyaa tidak.
2. A.logam aluminium = merupakan logam sehingga dapat menghantarkan listrik.
B.Aluminium cair = dapat menghantarkan listrik.
C.Klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas
hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus
listrikk karena gas klorin merupakan senyawa kovalen non polar.
D.Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL
memilikii kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak
dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion
didalamnya.
E.Lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya
burukk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian
sehinggaa hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus
listrik.
F.Larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion -
ionn dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat
bebas.
G.Lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan
senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama
sekali tidak ada yang terurai.
H.Larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus
litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya
Nama:Lenip Yunipia
Kelas: X MIPA 2
Tanggal:25-01-2021
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida.
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat.
C. Jenis elektrolit=senyawa ion
Padatan=non konduktor
Lelehan=konduktor
Larutan=konduktor.
D. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai
larutann&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki
titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik &
cairannyaa tidak.
2. A.logam aluminium = merupakan logam sehingga dapat menghantarkan listrik.
B.Aluminium cair = dapat menghantarkan listrik.
C.Klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas
hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus
listrikk karena gas klorin merupakan senyawa kovalen non polar.
D.Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL
memilikii kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak
dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion
didalamnya.
E.Lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya
burukk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian
sehinggaa hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus
listrik.
F.Larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion -
ionn dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat
bebas.
G.Lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan
senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama
sekali tidak ada yang terurai.
H.Larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus
litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya.
nama : keyza kharisma hamada
kelas: x mipa 2
Jawaban
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. a. logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya
Nama : Ranti Santika
Kelas : X MIPA 3
Jawaban
1.a) golongan zat murni yang dapat menghantarkan listrik adalah golongan cair
b) senyawa ion yaitu kalium dan klorida senyawa kakalen yaitu bromin,air,asam,
Cuka,entanol gula dan asam sulfat
C) a.Jenis elektrolit=senyawa ion
Padatan = non konduktor
Lelehan = konduktor
Larutan= konduktor
B. Jenis elektrolit = senyawa kavalen
Padatan = non konduktor
Lelehan = non konduktor
Larutan = konduktor
2.a.logam alumunium : dapat karena bersifat konduktor
b.alumunium cair : dapat karena cairan juga konduktor
c.klorin NaCI : tidak dapat karena bersifat isolator
d.kristal NaCI : tidak dapat karena bersifat isolator listrik
e.larutan NaCI : dapat bersifat konduktor segala cairan
g.lelehan asam asetat murni : dapat karena berupa lelehan yang bersifat konduktor
h.larutan asam asetat : dapat karena berupa larutan
I.kristal gula : tidak dapat karena isolator listrik
j.larutan gula : dapat karena berupa larutan
25 Januari 2021 11:54
Nama: Elin Auliasari
Kelas:X MIPA 2
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida.
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat.
C. Jenis elektrolit=senyawa ion
Padatan=non konduktor
Lelehan=konduktor
Larutan=konduktor.
D. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai
larutann&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki
titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik &
cairannyaa tidak.
2. A.logam aluminium = merupakan logam sehingga dapat menghantarkan listrik.
B.Aluminium cair = dapat menghantarkan listrik.
C.Klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas
hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus
listrikk karena gas klorin merupakan senyawa kovalen non polar.
D.Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL
memilikii kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak
dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion
didalamnya.
E.Lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya
burukk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian
sehinggaa hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus
listrik.
F.Larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion -
ionn dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat
bebas.
G.Lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan
senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama
sekali tidak ada yang terurai.
H.Larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus
litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya.
Nama : Sintia Lestari
Kelas : X MIPA 4
1. a). Golongan zat murni yang dapat menghantar listrik adalah golongan cair.
b). Senyawa ion: Kalium klorida.
Senyawa kovalen: Bromin, air, asam cuka, etanol, gula, asam sulfat.
c). "Senyawa Ion"
Padatan : non konduktor
Lelehan : konduktor
Larutan : Konduktor
"Senyawa Kovalen"
Padatan : non konduktor
Lelehan : non konduktor
Larutan : Konduktor
2. a).Logam aluminium = merupakan logam sehingga dapat menghantarkan listrik karena bersifat konduktor.
b). Aluminium cair = dapat menghantarkan listrik karena konduktor.
c) . Klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar.
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCl memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya.
e). Lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik.
f) . Larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas.
g) . Lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai.
h). Larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutan.
i) kristal gula dan j) . larutan gula = tidak dapat mengahantarkan arus listrik, merupakan senyawa kovalen non polar, dan tidak ada ion - ion yang terurai dalam kristal ataupun dalam bentuk larutannya.
Nama:Hari kurnia nurohman
Kelas:X MIPA2
1.A.golongan zat murni yang menghantarkan arus listrik adalah golongan cair
B.senyawa ion:kalium klorida
senyawa kovalen:kromin,air,asam,cika,etanol,gula,dan asam sulfat
C.perbedaannya terjadi pada daya hantar listrik dan titik didihnya.untuk senyawa ion cenderung mempunyai larutan dan cairan yg menghantarkan listrik sedangkan kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik dan cairannya tidak
2.A.logam alumunium=merupakan logam sehingga dapat menghantarkan listrik
B.alumunium cair=dapat menghantar listrik
C.klorin NACL=disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NACL.maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar.
D.kristal NACL=tidak dapat menghantarkan arus listrik dikarenakan padatan NACL memiliki kerapan yg sangat tinggi dan ion -ion dalam padatan NACL tidak dalam bergerak bebas sekalipun NACL adalah senyawa dengan ikatan ion didalamnya
E.lelehan NACL=dapat menghantarkan tetapi daya hantar arus listriknya buruk,dikarenakan pada lelehan NACL ion -ion hanya terurai sebagian sehingga hanya sedikit dari ion-ion tersebut yanf dapat menghantarkan arus listrik
F.larutan NACL=dapat menghantarkan arus listrik dengan baik, dikarenakan ion-ion dalam larutannya terurai sempurna dan ion-ion tersebut bergerak sangat bebas
G.lelehan asam asetat murni=tidak dapat menghantarkan arus listrik merupakan senyawa kovalen polar,dalam fase lelehan ion-ion dalam asam asetat sama sekali tidak ada yang terjadi
H.larutan asam asetat=dapat menghantarkan arus listrik tetapi daya hantar arus listriknya lemah,karena hanya sebagian ion-ion yang terurai dalam larutannya.
Nama:Lisa Fitriyani
Kelas:X MIPA 2
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. a. logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya
JAWABAN
NAMA:DINDA SELVIYANI
KELAS: X MIPA 4
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida.
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat.
C. Jenis elektrolit=senyawa ion
Padatan=non konduktor
Lelehan=konduktor
Larutan=konduktor.
D. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai
larutann&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki
titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik &
cairannyaa tidak.
2. A.logam aluminium = merupakan logam sehingga dapat menghantarkan listrik.
B.Aluminium cair = dapat menghantarkan listrik.
C.Klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas
hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus
listrikk karena gas klorin merupakan senyawa kovalen non polar.
D.Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL
memilikii kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak
dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion
didalamnya.
E.Lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya
burukk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian
sehinggaa hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus
listrik.
F.Larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion -
ionn dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat
bebas.
G.Lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan
senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama
sekali tidak ada yang terurai.
H.Larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus
litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya.
Nama : Dea ananda putri
Kelas : X Mipa-3
No.1
A).Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B). Senyawa ion : kalium klorida.
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat.
C). Jenis elektrolit=senyawa ion
Padatan=non konduktor
Lelehan=konduktor
Larutan=konduktor.
D). Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai
larutann&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki
titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik &
cairannyaa tidak.
No.2
A).logam aluminium = merupakan logam sehingga dapat menghantarkan listrik.
B).Aluminium cair = dapat menghantarkan listrik.
C).Klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas
hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus
listrikk karena gas klorin merupakan senyawa kovalen non polar.
D).Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL
memilikii kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak
dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion
didalamnya.
E).Lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya
burukk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian
sehinggaa hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus
listrik.
F).Larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion -
ionn dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat
bebas.
G).Lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan
senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama
sekali tidak ada yang terurai.
H).Larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus
litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya.
Nama : Shivana Aulia Pramesty
Kelas : X Mipa-3
No.1
A).Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B). Senyawa ion : kalium klorida.
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat.
C). Jenis elektrolit=senyawa ion
Padatan=non konduktor
Lelehan=konduktor
Larutan=konduktor.
D). Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai
larutann&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki
titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik &
cairannyaa tidak.
No.2
A).logam aluminium = merupakan logam sehingga dapat menghantarkan listrik.
B).Aluminium cair = dapat menghantarkan listrik.
C).Klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas
hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus
listrikk karena gas klorin merupakan senyawa kovalen non polar.
D).Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL
memilikii kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak
dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion
didalamnya.
E).Lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya
burukk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian
sehinggaa hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus
listrik.
F).Larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion -
ionn dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat
bebas.
G).Lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan
senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama
sekali tidak ada yang terurai.
H).Larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus
litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya.
Nama:Farabilla Cahyani
Kelas :X mipa 1
1. a). golongan zat murni yang dapat menghantarkan listrik adalah golongan cair
b). senyawa ion=kalium klorida
senyawa kovalen=bromin,air,asam cuka,etanol,gula,asam sulfat.
c). senyawa ion= bentuk padatan:non konduktor
bentuk lelehan:konduktor
bentuk larutan:konduktor
senyawa kovalen= bentuk padatan: non konduktor
bentuk lelehan: non konduktor
bentuk larutan: konduktor
2. -logam aluminium:bisa,karena bersifat konduktor
-aluminium cair:bisa,karena cairan bersifat konduktor
-klorin cair:tidak bisa,karena bersifat isolator
-kristal NaCL:tidak bisa,karena bersifat isolator listrik
-lelehan NaCL:bisa,karena konduktor listrik
-larutan NaCL:bisa,karena konduktor segala cairan
-lelehan asam asetat murni:bisa,karena beruoa lelehan yang bersifat konduktor
-larutan asam asetat:bisa,karena berupa larutan
-kristal gula:tidak bisa,karena bersifat isolator listrik
-larutan gula:bisa,karena berupa larutan
Nama : Wafa Laila Kausar
Kelas: X MIPA 3
Jawaban
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. a. logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya
Nama: Salsabila Anatasya Aisyah
Kelas: X MIPA 4
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida.
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat.
C. Jenis elektrolit=senyawa ion
Padatan=non konduktor
Lelehan=konduktor
Larutan=konduktor.
D. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai
larutann&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki
titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik &
cairannyaa tidak.
2. A.logam aluminium = merupakan logam sehingga dapat menghantarkan listrik.
B.Aluminium cair = dapat menghantarkan listrik.
C.Klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas
hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus
listrikk karena gas klorin merupakan senyawa kovalen non polar.
D.Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL
memilikii kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak
dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion
didalamnya.
E.Lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya
burukk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian
sehinggaa hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus
listrik.
F.Larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion -
ionn dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat
bebas.
G.Lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan
senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama
sekali tidak ada yang terurai.
H.Larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus
litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya.
Nama:Farina Yayang Nurhalizah
Kelas:x mipa 3
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. a. logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya
Nama:Melani
Kelas: X MIPA 2
Jawaban
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. a. logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya.
Nama:Siti Aisyah
Kelas:X mipa 4
Jawaban
1
a)golongan zat murni yang dapat menghantarkan listrik adalah golongan cair
b)senyawa ion yaitu kalium dan klorida
senyawa kovalen yaitu bromin,air,asam cuka,etanol,gula dan asam sulfat
c)a)jenis elektrolit=senyawa ion
padatan=non konduktor
lelehan=konduktor
larutan=konduktor
b)jenis elektorlit=senyawa kovalen
padatan=nonkonduktor
lelehan=non konduktor
larutan=konduktor
2
a.logam aluminium=dapat karena bersifat konduktor
b. aluminium cair=dapat karena cairan juga konduktor
c. klorin NaCl=tdk dpt karena bersifat isolator
d. Kristal NaCl=tdk dapat karena bersifat isolator listrik
e. lelehan NaCl=dapat karena bersifat konduktor listrik
f. larutan NaCl:dapat,bersifat konduktorsegala cairan
g. lelehan asam asetat murni=dapat karena berupa lelehan yang bersifat konduktor
h. larutan asam asetat=dapat,karena berupa larutan
i. kristal gula=tdk dapat karena isolator listrik
j. larutan gula=dapat=karena berupa larutan
Nama : Zakiyatun Nufus
Kelas : X MIPA 4
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. a. logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya
Nama : Aulia Shafa Damayanti
Kelas : X MIPA 2
1.) A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida.
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat.
C. Jenis elektrolit=senyawa ion
Padatan=non konduktor
Lelehan=konduktor
Larutan=konduktor.
D. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai
larutann&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki
titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik &
cairannyaa tidak.
2. A.logam aluminium = merupakan logam sehingga dapat menghantarkan listrik.
B.Aluminium cair = dapat menghantarkan listrik.
C.Klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas
hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus
listrikk karena gas klorin merupakan senyawa kovalen non polar.
D.Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL
memilikii kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak
dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion
didalamnya.
E.Lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya
burukk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian
sehinggaa hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus
listrik.
F.Larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion -
ionn dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat
bebas.
G.Lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan
senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama
sekali tidak ada yang terurai.
H.Larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus
litriknya lemah, karena hanya sebagian ion-ion yang terurai dalam larutannya.
Sheza Nazwa aulia
X MIPA 1
Jawaban
1
a)golongan zat murni yang dapat menghantarkan listrik adalah golongan cair
b)senyawa ion yaitu kalium dan klorida
senyawa kovalen yaitu bromin,air,asam cuka,etanol,gula dan asam sulfat
c)a)jenis elektrolit=senyawa ion
padatan=non konduktor
lelehan=konduktor
larutan=konduktor
b)jenis elektorlit=senyawa kovalen
padatan=nonkonduktor
lelehan=non konduktor
larutan=konduktor
2
a.logam aluminium=dapat karena bersifat konduktor
b. aluminium cair=dapat karena cairan juga konduktor
c. klorin NaCl=tdk dpt karena bersifat isolator
d. Kristal NaCl=tdk dapat karena bersifat isolator listrik
e. lelehan NaCl=dapat karena bersifat konduktor listrik
f. larutan NaCl:dapat,bersifat konduktorsegala cairan
g. lelehan asam asetat murni=dapat karena berupa lelehan yang bersifat konduktor
h. larutan asam asetat=dapat,karena berupa larutan
i. kristal gula=tdk dapat karena isolator listrik
j. larutan gula=dapat=karena berupa larutan
1) a.golongan zat murni yang dapat menghantarkan listrik adalah golongan cair
b.senyawa ion yaitu kalium dan klorida
senyawa kovalen yaitu bromin,air,asam cuka,etanol,gula dan asam sulfat
c.a)jenis elektrolit=senyawa ion
padatan=non konduktor
lelehan=konduktor
larutan=konduktor
b)jenis elektorlit=senyawa kovalen
padatan=nonkonduktor
lelehan=non konduktor
larutan=konduktor
2) a.logam aluminium=dapat karena bersifat konduktor
b. aluminium cair=dapat karena cairan juga konduktor
c. klorin NaCl=tdk dpt karena bersifat isolator
d. Kristal NaCl=tdk dapat karena bersifat isolator listrik
e. lelehan NaCl=dapat karena bersifat konduktor listrik
f. larutan NaCl:dapat,bersifat konduktorsegala cairan
g. lelehan asam asetat murni=dapat karena berupa lelehan yang bersifat konduktor
h. larutan asam asetat=dapat,karena berupa larutan
i. kristal gula=tdk dapat karena isolator listrik
j. larutan gula=dapat=karena berupa larutan
NAMA: RIDAMAULIDA
KELAS: X MIPA 2
1) a.golongan zat murni yang dapat menghantarkan listrik adalah golongan cair
b.senyawa ion yaitu kalium dan klorida
senyawa kovalen yaitu bromin,air,asam cuka,etanol,gula dan asam sulfat
c.a)jenis elektrolit=senyawa ion
padatan=non konduktor
lelehan=konduktor
larutan=konduktor
b)jenis elektorlit=senyawa kovalen
padatan=nonkonduktor
lelehan=non konduktor
larutan=konduktor
2) a.logam aluminium=dapat karena bersifat konduktor
b. aluminium cair=dapat karena cairan juga konduktor
c. klorin NaCl=tdk dpt karena bersifat isolator
d. Kristal NaCl=tdk dapat karena bersifat isolator listrik
e. lelehan NaCl=dapat karena bersifat konduktor listrik
f. larutan NaCl:dapat,bersifat konduktorsegala cairan
g. lelehan asam asetat murni=dapat karena berupa lelehan yang bersifat konduktor
h. larutan asam asetat=dapat,karena berupa larutan
i. kristal gula=tdk dapat karena isolator listrik
j. larutan gula=dapat=karena berupa larutan
NAMA: RIDAMAULIDA
KELAS: X MIPA 2
1) a.golongan zat murni yang dapat menghantarkan listrik adalah golongan cair
b.senyawa ion yaitu kalium dan klorida
senyawa kovalen yaitu bromin,air,asam cuka,etanol,gula dan asam sulfat
c.a)jenis elektrolit=senyawa ion
padatan=non konduktor
lelehan=konduktor
larutan=konduktor
b)jenis elektorlit=senyawa kovalen
padatan=nonkonduktor
lelehan=non konduktor
larutan=konduktor
2) a.logam aluminium=dapat karena bersifat konduktor
b. aluminium cair=dapat karena cairan juga konduktor
c. klorin NaCl=tdk dpt karena bersifat isolator
d. Kristal NaCl=tdk dapat karena bersifat isolator listrik
e. lelehan NaCl=dapat karena bersifat konduktor listrik
f. larutan NaCl:dapat,bersifat konduktorsegala cairan
g. lelehan asam asetat murni=dapat karena berupa lelehan yang bersifat konduktor
h. larutan asam asetat=dapat,karena berupa larutan
i. kristal gula=tdk dapat karena isolator listrik
j. larutan gula=dapat=karena berupa larutan
NAMA: RIDAMAULIDA
KELAS: X MIPA 2
NAMA: sutihat
KELAS : X MIPA 4
JAWABAN
1. A.Golongan zat Murni yang dapat menghantarkan listrik adalah golongan cair
B.Senyawa ion : Kalium klorida.
Senyawa kovalen : bromin, air, asam cuka, etanol, gula, asam sulfat.
C.Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan
Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. A.logam aluminium=dapat karena bersifat konduktor
B.aluminium cair=dapat karena cairan juga konduktor
C.klorin Cair =tdk dpt karena bersifat isolator
D.Kristal NaCl=tdk dapat karena bersifat isolator listrik
E.lelehan NaCl=dapat karena bersifat konduktor listrik
F.larutan NaCl:dapat,bersifat konduktorsegala cairan
G.lelehan asam asetat murni=dapat karena berupa lelehan yang bersifat konduktor
H.kristal gula=tdk dapat karena isolator listrik
I.larutan gula=dapat=karena berupa larutan
24 Mei 2021. 10.35
1.A.Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
b.Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
c.Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2.A.logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya
NAMA: RAMADHAN MAULANA ANDHIKA
KELAS: X MIPA 2
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida.
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat.
C. Jenis elektrolit=senyawa ion
Padatan=non konduktor
Lelehan=konduktor
Larutan=konduktor.
D. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai
larutann&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki
titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik &
cairannyaa tidak.
2. A.logam aluminium = merupakan logam sehingga dapat menghantarkan listrik.
B.Aluminium cair = dapat menghantarkan listrik.
C.Klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas
hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus
listrikk karena gas klorin merupakan senyawa kovalen non polar.
D.Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL
memilikii kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak
dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion
didalamnya.
E.Lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya
burukk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian
sehinggaa hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus
listrik.
F.Larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion -
ionn dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat
bebas.
G.Lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan
senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama
sekali tidak ada yang terurai.
H.Larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus
litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya.
Nama: Ramadhan Maulana Andhika
Kelas: X MIPA 2
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida.
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat.
C. Jenis elektrolit=senyawa ion
Padatan=non konduktor
Lelehan=konduktor
Larutan=konduktor.
D. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai
larutann&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki
titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik &
cairannyaa tidak.
2. A.logam aluminium = merupakan logam sehingga dapat menghantarkan listrik.
B.Aluminium cair = dapat menghantarkan listrik.
C.Klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas
hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus
listrikk karena gas klorin merupakan senyawa kovalen non polar.
D.Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL
memilikii kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak
dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion
didalamnya.
E.Lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya
burukk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian
sehinggaa hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus
listrik.
F.Larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion -
ionn dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat
bebas.
G.Lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan
senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama
sekali tidak ada yang terurai.
H.Larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus
litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya.
Nama: Ayu Permatasari
Kelas: X MIPA 3
JAWABAN :
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida.
Senyawa kovalen : air , asam , etanol , asam sulfat , bromin , cuka
C. Jenis elektrolit ; senyawa ion
Padatan ; non konduktor
Lelehan ; konduktor
Larutan ; konduktor
D. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai
larutan & cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki
titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik &
cairannyaa tidak.
2. A. logam aluminium ; merupakan logam sehingga dapat menghantarkan listrik.
B. Aluminium cair ; dapat menghantarkan listrik.
C. Klorin NaCl ; disini klorin dalam bentuk apa?jika klorin dalam bentuk gas
hasil dari elektrolisis NaCl , maka klorin tidak dapat menghantarkan arus
listrikk karena gas klorin merupakan senyawa kovalen non polar.
D. Kristal NaCl ; tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL
memilikii kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak
dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion
didalamnya.
E. Lelehan NaCl ; dapat menghantarkan listrikn tetapi daya hantar arus litriknya
buruk , dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian
sehinggaa hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus
listrik.
F. Larutan NaCl ; dapat mebghantarkan arus listrik dengan baik, dikarenakan ion -
ionn dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat
bebas.
G. Lelehan asam asetat murni ; tidak dapat menghantarkan arus listrik, merupakan
senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama
sekali tidak ada yang terurai.
H. Larutan asam asetat ; dapat menghantarkan arus listrik tetapi daya hantar arus
litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam
larutannya.
NAMA: DINDA SELVIYANI
KELAS: X MIPA4
JAWABAN :
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida.
Senyawa kovalen : air , asam , etanol , asam sulfat , bromin , cuka
C. Jenis elektrolit ; senyawa ion
Padatan ; non konduktor
Lelehan ; konduktor
Larutan ; konduktor
D. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai
larutan & cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki
titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik &
cairannyaa tidak.
2. A. logam aluminium ; merupakan logam sehingga dapat menghantarkan listrik.
B. Aluminium cair ; dapat menghantarkan listrik.
C. Klorin NaCl ; disini klorin dalam bentuk apa?jika klorin dalam bentuk gas
hasil dari elektrolisis NaCl , maka klorin tidak dapat menghantarkan arus
listrikk karena gas klorin merupakan senyawa kovalen non polar.
D. Kristal NaCl ; tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL
memilikii kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak
dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion
didalamnya.
E. Lelehan NaCl ; dapat menghantarkan listrikn tetapi daya hantar arus litriknya
buruk , dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian
sehinggaa hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus
listrik.
F. Larutan NaCl ; dapat mebghantarkan arus listrik dengan baik, dikarenakan ion -
ionn dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat
bebas.
G. Lelehan asam asetat murni ; tidak dapat menghantarkan arus listrik, merupakan
senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama
sekali tidak ada yang terurai.
H. Larutan asam asetat ; dapat menghantarkan arus listrik tetapi daya hantar arus
litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam
larutannya.
Nama : putri ayudiyah
Kelas :x MIPA 4
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida.
Senyawa kovalen : air , asam , etanol , asam sulfat , bromin , cuka
C. Jenis elektrolit ; senyawa ion
Padatan ; non konduktor
Lelehan ; konduktor
Larutan ; konduktor
D. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai
larutan & cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki
titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik &
cairannyaa tidak.
2. A. logam aluminium ; merupakan logam sehingga dapat menghantarkan listrik.
B. Aluminium cair ; dapat menghantarkan listrik.
C. Klorin NaCl ; disini klorin dalam bentuk apa?jika klorin dalam bentuk gas
hasil dari elektrolisis NaCl , maka klorin tidak dapat menghantarkan arus
listrikk karena gas klorin merupakan senyawa kovalen non polar.
D. Kristal NaCl ; tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL
memilikii kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak
dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion
didalamnya.
E. Lelehan NaCl ; dapat menghantarkan listrikn tetapi daya hantar arus litriknya
buruk , dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian
sehinggaa hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus
listrik.
F. Larutan NaCl ; dapat mebghantarkan arus listrik dengan baik, dikarenakan ion -
ionn dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat
bebas.
G. Lelehan asam asetat murni ; tidak dapat menghantarkan arus listrik, merupakan
senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama
sekali tidak ada yang terurai.
H. Larutan asam asetat ; dapat menghantarkan arus listrik tetapi daya hantar arus
litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam
larutannya.
NAMA;MAYA WIJAYANTI
KELAS;X MIPA 1
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida.
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat.
C. Jenis elektrolit=senyawa ion
Padatan=non konduktor
Lelehan=konduktor
Larutan=konduktor.
D. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai
larutann&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki
titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik &
cairannyaa tidak.
2. A.logam aluminium = merupakan logam sehingga dapat menghantarkan listrik.
B.Aluminium cair = dapat menghantarkan listrik.
C.Klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas
hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus
listrikk karena gas klorin merupakan senyawa kovalen non polar.
D.Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL
memilikii kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak
dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion
didalamnya.
E.Lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya
burukk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian
sehinggaa hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus
listrik.
F.Larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion -
ionn dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat
bebas.
G.Lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan
senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama
sekali tidak ada yang terurai.
H.Larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus
litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya.
Nama: Novianti manurung
Kelas: X MIPA 3
Pelajaran: kimia
1)
A) golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B)senyawa ion:kalium klorida
Senyawa kovalen:bromin, air, asam cuka,gula,asam sulfat , etanol
C) senyawa ion:
-bentuk padatan:tidak menghantarkan arus listrik
-bentuk lelehan:menghantarkan arus listrik
-bentuk larutan: menghantarkan arus listrik
Senyawa kovalen polar :
-bentuk padatan:tidak menghantarkan arus listrik
-bentuk lelehan:tidak menghantarkan arus listrik
-bentuk larutan:menghantarkan arus listrik
2)
A)logam mulia : dapat menghantarkan listrik
B)alumunium cair : dapat menghantarkan listrik karna cairan juga dapat menghantarkan listrik
C)klorin NaCI : tidak dapat karna bersifat isolator
D)kristal NaCI : tidak dapat karna bersifat isolator listrik
E)lelehan NaCI : dapat karna bersifat konduktor listrik
F)larutan NaCI : dapat menghantarkan karna semua cairan bersifat konduktor
G)lelehan asam asetat murni : dapat karna bersifat konduktor segala cairan
H) larutan asam asetat : dapat karna berupa larutan
I) kristal gula : tidak dapat karna isolator listrik
J)larutan gula : dapat karna berupa larutan
Nama : Ragyl Wira Ramadhan
Kelas : X MIPA 3
1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat
C. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai larutan&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik & cairannya tidak
2. a. logam aluminium = merupakan logam sehingga dapat menghantarkan listrik
b. aluminium cair = dapat menghantarkan listrik
c. klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus listrik karena gas klorin merupakan senyawa kovalen non polar
d. Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL memiliki kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion didalamnya
e. lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya buruk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian sehingga hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus listrik
f. larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion - ion dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat bebas
g. lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama sekali tidak ada yang terurai
h. larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus litriknya lemah, karena hanya sebagian ion - ion yang terurai dalam larutannya
Nama:Ulan Ramadani
Kelas: X MIPA 4
1)1. A. Golongan zat murni yang dapat menghantarkan arus listrik adalah golongan cair
B. Senyawa ion : kalium klorida.
Senyawa kovalen : bromin, air, asam cika, etanol, gula, dan asam sulfat.
C. Jenis elektrolit=senyawa ion
Padatan=non konduktor
Lelehan=konduktor
Larutan=konduktor.
D. Perbedaannya terjadi pada daya hantar listrik & titik didihnya.
Untuk senyawa ion cenderung mempunyai titik didih/leleh yg tinggi, mempunyai
larutann&cairan yg menghantarkan listrik sedangkan, Kovalen polar memiliki
titik didih/leleh rendah dan hanya pada larutan saja yg menghantar listrik &
cairannyaa tidak.
2. A.logam aluminium = merupakan logam sehingga dapat menghantarkan listrik.
B.Aluminium cair = dapat menghantarkan listrik.
C.Klorin NaCl = disini klorin dalam bentuk apa?jika klorin dalam bentuk gas
hasil dari elektrolisis NaCl, maka klorin tidak dapat menghantarkan arus
listrikk karena gas klorin merupakan senyawa kovalen non polar.
D.Kristal NaCl = tidak dapat menghantarkan aruslistrik dikarenakan padatan NaCL
memilikii kerapatan yang sangat tinggi dan ion - ion dalam padatan NaCl tidak
dapat bergerak bebas sekalipun NaCl adalah senyawa dengan ikatan ion
didalamnya.
E.Lelehan NaCl = dapat menghantarkan listrikn tetapi daya hantar arus litriknya
burukk, dikarenakan pada lelehan NaCl ion - ionnya hanya terurai sebagian
sehinggaa hanya sedikit dari ion - ion tersebut yang dapat menghantarkan arus
listrik.
F.Larutan NaCl = dapat mebghantarkan arus listrik dengan baik, dikarenakan ion -
ionn dalam larutannya terurai sempurna dan ion - ion tersebut bergerak sangat
bebas.
G.Lelehan asam asetat murni = tidak dapat menghantarkan arus listrik, merupakan
senyawa kovalen polar, dalam fasa lelehan ion - ion dalam asam asetat sama
sekali tidak ada yang terurai.
H.Larutan asam asetat = dapat menghantarkan arus listrik tetapi daya hantar arus
litriknya lemah, karena hanya sebagian ion-ion yang terurai dalam larutannya.
Posting Komentar