A.
Massa
Atom Relatif (Ar) dan Massa Molekul Relatif (Mr)
1.
Massa
Atom Relatif (Ar)
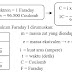
Massa atom relatif suatu unsur adalah
perbandingan massa rata-rata unsur dengan
Massa
1 atom C-12 = 12 satuan massa atom (sma)
Contoh:
Tentukan
massa atom relatif dari atom He yang massa rata-ratanya 4,003 sma!
Jawab:
2. Massa Molekul Relatif (Mr)
Massa molekul relatif adalah perbandingan
massa 1 molekul dengan
Molekul terbentuk dari atom-atom, sehingga Mr merupakan penjumlahan Ar dari unsur-unsur yang menyusun
molekul.
Contoh:
Tentukan massa molekul relatif H2SO4
bila diketahui Ar H = 1, Ar S = 32, dan Ar O =16!
Jawab:
Mr H2SO4
= (2 x Ar H) + (1 x Ar S) + (4 x Ar O)
= (2 x 1) + (1 x 32) + (4 x 16)
= 98
Latihan 1.1
Tentukan massa molekul relatif (Mr) jika diketahui Ar
H = 1; O = 16; S = 32; Cl = 35,5; Cu = 63,5; Mg = 24.
a. CuSO4
c. Mg
(OH)2
b. H2SO4
d. HCl
B. Menentukan
Elektron Valensi
1.
Konfigurasi
Elektron
Konfigurasi (susunan) elektron suatu atom
berdasarkan kulit-kulit atom tersebut. Setiap kulit atom dapat terisi elektron
maksimum 2n2, di mana n merupakan letak kulit.
Jika
n = 1 maka berisi 2 elektron
Jika
n = 2 maka berisi 8 elektron
Jika
n = 3 maka berisi 18 elektron, dan seterusnya.
Tabel Jumlah Elektron Maksimum Setiap
Kulit
Perhatikan konfigurasi elektron pada
unsur dengan nomor atom 19. Konfigurasi elektronnya K L M N
bukanlah 2 8 9
tetapi
2 8 8 1
1.
Elektron
Valensi
Elektron valensi adalah elektron-elektron
yang menghuni kulit terluar dari suatu atom, yaitu kulit yang paling jauh
dari inti.
Contoh:
Berapakah
elektron valensi dari natrium? Konfigurasi elektron 11Na = 2
8 1. Kulit terluar dihuni 1
elektron. Jadi elektron vaelnsi dari natrium = 1.
Unsur-unsur
yang mempunyai jumlah elektron valensi yang sama akan memiliki sifat kimia yang
sama pula.
Latihan 1.2
1. Tuliskan
konfigurasi elektron dari atom-atom dengan nomor atom: 5, 11, dan 16.
2. Tuliskan
konfigurasi elektron suatu atom yang memiliki nomor massa 35 dan jumlah neutron
18.
3. Tuliskan
konfigurasi elektron suatu atom dengan nomor atom: 31, 38, dan 52.
4. Tuliskan
konfigurasi elektron suatu atom yang memiliki nomor massa dan jumlah neutron
sebagai berikut: 32 dan 16; 33 dan 17; 34 dan 18.
5. Tentukan
berapakah elektron valensi dari unsur-unsur berikut: 9F, 13Al,
16S, dan 53I.













Tidak ada komentar:
Posting Komentar