Isotop, Isobar, dan Isoton
Tujuan Pembelajaran :
1.
Menjelaskan pengertian isotop, isobar, dan
isoton.
2.
Memberikan contoh isotop, isobar, dan
isoton.
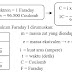
adanya
unsur-unsur yang memiliki jumlah proton yang sama tetapi memiliki massa atom
yang berbeda. Ada pula unsur-unsur yang memiliki massa atom yang sama tetapi
nomor atom berbeda. Oleh karena itu, dikenallah istilah isotop, isoton, dan
isobar.