Tekanan Osmotik (π)
- Peserta didik dapat menjelaskan pengertian osmosis dan tekanan osmosis serta contoh terapannya dalam kegidupan sehari-hari dan industri.
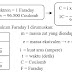
Osmosis adalah proses spontan perpindahan molekul
pelarut dari larutan yang encer ke larutan yang lebih pekat melalui membran
semipermeabel. Membran semipermeabel adalah suatu selaput yang dapat dilalui
molekul-molekul pelarut dan tidak dapat dilalui oleh zat terlarut (menahan zat
terlarut).
Gambar. Proses tekanan osmosis pada larutan urea 10% dan
5%.
Tekanan osmotik suatu larutan adalah tekanan luar yang
dikenakan pada larutan untuk menghentikan osmosis. Makin besar kosentrasi
larutan maka makin besar pula tekanan osmosisnya. Dua larutan yang mempunyai
tekanan osmotik sama disebut isotonik. Larutan yang tekanan osmotiknya lebih
besar dibandingkan dengan larutan lain dinyatakan sebagai larutan yang
hipertonik. Dan larutan yang tekanan osmotiknya lebih kecil dibanding dengan
larutan lain dinyatakan sebagai hipotonik.
Di rumah sakit, larutan
infus yang dimasukkan ke dalam tubuh pasien melalui pembuluh darah haruslah
bersifat isotonik dengan sel-sel darah. Jika larutan infus itu hipertonik maka
akan terjadi krenasi (air keluar dari sel darah) sehingga sel mengkerut dan
rusak. Dan jika larutan infus itu hipotonik maka terjadilah hemolisis (air
masuk ke sel darah) yang menyebabkan sel menggelembung dan pecah.
Menurut Van’t Hoff tekanan osmotik
dirumuskan dengan:
Keterangan :
π
= tekanan osmotik (atm)
M
= molaritas larutan → M =
R
= tetapan Reyberg = 0,082 L atm/K0mol
T
= suhu 0K
Contoh Soal
Sebanyak 3 gram urea (Mr =
60) dilarutkan dalam air hingga volume larutan 500 mL. Hitunglah tekanan
osmotik larutan pada suhu 27 °C!
Jawab:
π = M . R . T =
=
=
0,1 . 0,082 . 300 atm = 2,46 atm
|
Kegiatan Mandiri: · Rancang dan lakukan suatu kegiatan untuk menunjukkan dan mempelajari pentingnya osmosis dalam kehidupan manusia. |
Latihan
1.
Suatu
larutan nonelektrolit pada suhu 25 °C memiliki tekanan osmotik sebesar 0,246
atm. Berapakah kemolaran larutan tersebut?
2.
Sebanyak
10 gram zat nonelektrolit dilarutkan dalam air hingga volume larutan 500 mL pada
suhu 25 °C. Ternyata larutan yang terjadi isotonik dengan larutan glukosa 0,04
mol/liter. Hitunglah massa molekul relatif zat tersebut!
3.
Bila
tekanan osmotik darah manusia pada suhu 37°C adalah 7,7 atm, berapa gram
glukosa C6H12O6 yang diperlukan untuk membuat
500 mL larutan yang isotonik dengan darah? (Ar C = 12, H = 1, O = 16)











Tidak ada komentar:
Posting Komentar